Стенозирующие поражения митрального клапана изменяют его диастолическое движение и легко могут быть распознаны с помощью М-модальной и двумерной эхокардиографии. Патология митрального клапана, сопровождающаяся митральной недостаточностью, часто малозаметна, и диагностировать ее сложнее. Это происходит потому, что движения митрального клапана в систолу минимальны, но если даже малая часть клапана функционирует неправильно, то возникает выраженная митральная регургитация. Тем не менее в большом количестве случаев митральной недостаточности все-таки можно выявить ее анатомические причины с помощью эхокардиографии.
Данные, приведенные в табл. 11, дают представление об основных этиологических причинах митральной регургитации. Эта таблица основана на результатах проводившейся в 1976—81 гг. работы, в которой исследовались данные эхокардиографии, ангиографии и оперативного лечения у 173 больных с митральной регургитацией [88]. Заметим, что пролапс митрального клапана оказался ведущей причиной митральной регургитации.
| Таблица 11. Этиология митральной регургитации | ||
| Число случаев | Доля от общего числа, % | |
| Пролапс митрального клапана | 56 | 32,3 |
| Ревматизм | 40 | 23,1 |
| Заболевания миокарда (дилатация ЛЖ — 11%, гипертрофия — 6%) | 30 | 17,3 |
| Ишемическая болезнь сердца | 27 | 15,6 |
| Бактериальный эндокардит | 11 | 6,3 |
| Врожденные пороки сердца | 9 | 5,2 |
| По материалам Delaye J, Beaune J, Gayet JL et al. Current etiology of organic mitral insufficiency in adults. Arch Mal Coeur 76:1072,1983 | ||
Допплеровское исследование играет очень важную роль в диагностике митральной недостаточности любой степени выраженности. Лучший метод поиска митральной регургитации — цветное допплеровское сканирование [81, 83, 97], так как оно обладает высокой чувствительностью, и его проведение не требует много времени. Цветное допплеровское сканирование дает информацию о митральной регургитации в реальном масштабе времени. Хотя представление о направлении и глубине проникновении регургитирующей струи может быть получено и в импульсном допплеровском режиме, цветное сканирование надежнее и технически проще, особенно при эксцентрической регургитации. Из апикального доступа митральная регургитация выглядит как появляющееся в систолу пламя светло-синего цвета, направленное в сторону левого предсердия (рис. 17.9). Для регистрации митральной недостаточности и определения степени ее выраженности метод цветного сканирования по чувствительности приближается к рентгеноконтрастной вентрикулографии.
Около 40—60% здоровых людей имеют митральную регургитацию, причиной которой является недостаточность задне-медиальной комиссуры митрального клапана, но это регургитация выраженная незначительно. Регургитирующая струя при этом проникает в полость левого предсердия менее чем на 2 см. Если поток проникает в полость левого предсердия более чем на половину его длины, достигает его задней стенки, заходит в ушко левого предсердия или в легочные вены, то это указывает на тяжелую митральную недостаточность. На рис. 17.9, 17.10, 17.11 представлена митральная регургитация небольшой, средней и высокой степени выраженности.
Следует иметь в виду, что при исследовании дилатированного левого предсердия происходит потеря чувствительности цветного сканирования на большой глубине, и можно недооценить выраженность митральной регургитации. Ширина формирующейся струи на уровне клапана и расхождение ее на предсердной стороне клапана также позволяют судить о степени митральной регургитации.
Как правило, если с помощью цветного сканирования митральная регургитация не обнаружена, то другие допплеровские методы для ее поисков уже не применяются. Однако при плохой визуализации сердца и цветное сканирование может оказаться недостаточно чувствительным. В случаях, когда трансторакальная эхокардиография технически трудна, а точное знание степени митральной регургитации необходимо, показано проведение чреспищеводной эхокардиографии. К обстоятельствам, затрудняющим оценку степени митральной регургитации при трансторакальном исследовании нужно отнести кальциноз митрального кольца и створок митрального клапана, а также наличие механического протеза в митральной позиции.
На рис. 17.2 представлено изображение незначительно выраженной митральной регургитации, полученное при чреспищеводном цветном допплеровском исследовании пациента с дилатированным левым предсердием. Заметим, что выбор правильного усиления привел к четкой визуализации «спонтанного контрастирования» левого предсердия, что свидетельствует о технически правильном проведении исследования и исключает недооценку степени митральной регургитации. На рис. 17.13 представлена незначительная митральная регургитация, типичная для нормально функционирующего протезированного митрального клапана. Рис. 17.14 иллюстрирует околоклапанную регургитацию высокой степени при дисковом протезе в митральной позиции.
На рис. 17.15 видно, как струя митральной регургитации заходит в гигантских размеров ушко левого предсердия.
При невозможности проведения цветного сканирования степень митральной регургитации определяют с помощью допплеровского исследования в импульсном режиме. Контрольный объем сначала устанавливают над местом смыкания створок митрального клапана в левое предсердие. Мы рекомендуем проводить поиск митральной регургитации в нескольких позициях, так как она может иметь эксцентрическое направление. Тщательное допплеровское исследование с помощью современной чувствительной аппаратуры часто выявляет ранние систолические сигналы низкой интенсивности, которые соответствуют так называемой «функциональной» митральной регургитации. Низкая плотность допплеровского спектра при обнаружении такой регургитации говорит о малом числе эритроцитов, в ней участвующих. Возможно, обнаружение такой незначительной регургитации связано с регистрацией движения небольшого количества эритроцитов, остающихся в конце диастолы в преддверии митрального отверстия.
При гемодинамически значимой митральной регургитации интенсивность допплеровского спектра существенно выше.
Однако из-за высокой скорости струи митральной регургитации, обусловленной большим градиентом давления в систолу между желудочком и предсердием, при импульсном допплеровском исследовании и при цветном сканировании возникает искажение допплеровского спектра. Чем больше объем регургитирующей крови, тем плотнее допплеровский спектр. Картирование допплеровского сигнала в импульсном режиме состоит в отслеживании регургитирующей струи, начиная от места смыкания створок митрального клапана и далее при перемещении контрольного объема в сторону верхней и боковой стенок левого предсердия. Этот метод определения степени митральной регургитации используют в тех случаях, когда нельзя провести цветное сканирование. Чем плотнее спектр митральной регургитации и чем глубже в левое предсердие она проникает, тем она тяжелее. С помощью постоянно-волнового исследования можно аккуратно измерить максимальную скорость митральной регургитации. Однако этот параметр мало существен для оценки степени выраженности митральной регургитации, поскольку максимальная скорость отражает большой систолический градиент давления между левым желудочком и предсердием, а он велик и в норме, и при патологии. Только при очень тяжелой митральной регургитации давление в левом предсердии в систолу достигает такой величины, что максимальная скорость регургитации уменьшается.
Для оценки степени тяжести митральной недостаточности можно применять двумерные и допплеровские методы вычисления объема регургитирующей крови. При митральной недостаточности объем крови, который поступает из левого желудочка в аорту, меньше объема, поступающего в желудочек в диастолу. Разность между значениями ударного объема, вычисленными планиметрическим (конечно-диастолический минус конечно-систолический объем) и допплеровским (произведение линейного интеграла скорости кровотока в выносящем тракте левого желудочка и площади выносящего тракта) способами, равна объему регургитирующей крови за каждый сердечный цикл. Однако эти вычисления дают большую ошибку, поскольку планиметрические измерения занижают, а допплеровские — завышают значения ударного объема.
Формула расчета фракции регургитирующего объема для оценки тяжести митральной недостаточности применяется редко в связи с высокой вероятностью ошибок. Мы все-таки считаем нужным привести способ расчета фракции регургитирующего объема (табл. 12). Заметим, что условием применимости приведенной формулы является отсутствие патологии аортального клапана.
| Таблица 12. Расчет фракции регургитирующего объема (RF) при митральной недостаточности |
| Позиции и измерения
1. Апикальная 2-камерная позиция 2. Апикальная 4-камерная позиция 3. Раскрытие аортального клапана в М-модальном режиме парастернально 4. Аортальный кровоток из апикального доступа в постоянно-волновом режиме |
| Расчетные параметры
1. Площадь отверстия аортального клапана (AVA) — по диаметру его раскрытия 2. Фракция регургитирующего объема (RF): а) Ударный объем (SVp) по Simpson б) Допплеровское вычисление ударного объема (SVd): SVd = AVA ´ VTI, где VTI — интеграл линейной скорости кровотока через аортальный клапан в) RF = (SVp – SVd)/SVp |
Косвенными показателями степени тяжести митральной недостаточности могут служить размеры левого предсердия и желудочка. Выраженная митральная недостаточность сопровождается дилатацией левого желудочка из-за его объемной перегрузки. Кроме того, повышается давление в легочной артерии, которое можно оценить, измерив скорость струи трикуспидальной регургитации.
Ревматическое поражение митрального клапана, как правило, выражается в сочетанном его поражении. При этом, несмотря на наличие анатомических признаков ревматического митрального стеноза, гемодинамически значимой обструкции приносящего тракта левого желудочка часто не обнаруживается. При эхокардиографическом исследовании в М-модальном и двумерном режиме даже в отсутствии изменений гемодинамики выявляются признаки ревматического поражения в виде утолщения и склерозирования створок, диастолического куполообразного закругления передней створки митрального клапана. В дифференциальной диагностике сочетанного поражения митрального клапана и «чистой» митральной недостаточности главную роль играет допплеровское исследование.
Пролапс митрального клапана был впервые описан как синдром, включающий клинические, аускультативные и электрокардиографические изменения, в середине 60-х годов. Тогда было показано, что средне-систолический щелчок и шум коррелируют с выявляющимся при ангиографии провисанием створок митрального клапана. Осознание важности этого синдрома произошло в начале 70-х годов, когда оказалось, что пролапс митрального клапана имеет яркие эхокардиографические проявления. И именно благодаря эхокардиографии стало ясно, насколько этот синдром распространен в популяции [114, 115]. Наибольшее значение в его диагностике имеет двумерная эхокардиография; допплеровские исследования дополняют ее, позволяя обнаружить позднюю систолическую митральную регургитацию и определить степень ее выраженности.
М-модальная эхокардиография дает около 40% ложно-отрицательных результатов, если за стандарт диагностики берется аускультация сердца. Возможно, такая низкая чувствительность метода связана с деформациями грудной клетки; показано, что до 75% пациентов с пролапсом митрального клапана имеют рентгенологические признаки костных деформаций грудной клетки. Такие деформации (например, pectus excavatum) могут сильно затруднить проведение М-модального исследования. Впрочем, гораздо важнее не помехи для эхокардиографии, а то, что скелетные изменения указывают на системный характер поражения соединительной ткани при пролапсе митрального клапана.
Диагностика пролапса митрального клапана требует обязательного сочетания М-модальной и двумерной эхокардиографии (рис. 8.8, 8.9). Двумерное исследование позволяет рассмотреть створки митрального клапана целиком и найти место их смыкания. Очевидное провисание клапанов в левое предсердие не создает диагностических проблем. Если же створки (или одна створка) доходят только до атриовентрикулярного бугорка, а не далее, это может вызвать диагностические трудности.
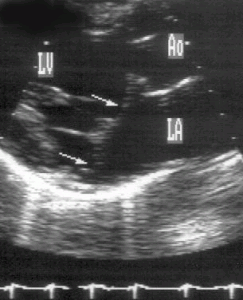
Рисунок 8.8. Пролапс митрального клапана: парастернальная позиция длинной оси левого желудочка, систола. Пролабируют обе створки митрального клапана (стрелки). Хорошо видно, что передняя створка имеет излишнюю, не соответствующую размерам желудочка, длину. LA — левое предсердие, LV — левый желудочек, Ao — восходящий отдел аорты.
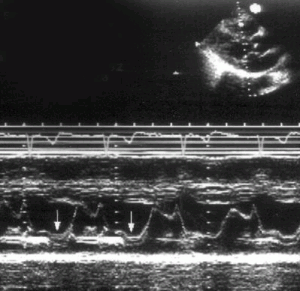
Рисунок 8.9. Поздне-систолический пролапс передней створки митрального клапана, М — модальное исследование. Пролабирование передней створки митрального клапана происходит в конце систолы (стрелки).
Ряд исследователей считают, что поскольку митральное кольцо имеет седловидную форму, и верхние точки его расположены спереди и сзади, то смещение створки выше уровня митрального кольца должно регистрироваться только из тех позиций, которые пересекают клапан в переднезаднем направлении [105]. Такими позициями являются парастернальная длинная ось левого желудочка и апикальная двухкамерная позиция. Было обнаружено, что добавление допплеровского исследования к М-модальному и двумерному дает специфичность диагностики пролапса митрального клапана равную 93%. Представляется, однако, что, диагностику пролапса митрального клапана нельзя основывать на допплеровском исследовании. Учитывая распространенность незначительной митральной регургитации, это может привести к гипердиагностике пролапса митрального клапана. По нашему мнению, диагностически важным результатом допплеровского исследования для распознавания пролапса митрального клапана может считаться только обнаружение поздней систолической митральной регургитации.
Кроме изменений траектории движения створок, пролапс митрального клапана сопровождается также их утолщением и деформацией. Обычно кончики створок поражены в наибольшей степени и похожи на головку булавки с матовой поверхностью. Утолщение створок иногда распространяется и на хорды. Такие изменения клапанного аппарата называются его миксоматозным перерождением (дегенерацией). Чем сильнее деформирован клапан, тем выше шансы обнаружить утолщение эндокарда межжелудочковой перегородки в том месте, где он соприкасается с чрезмерно подвижной передней створкой (аналогичное локальное утолщение эндокарда межжелудочковой перегородки часто обнаруживают и при гипертрофической кардиомиопатии). Чем сильнее деформированы створки, тем выше вероятность клинических проявлений и осложнений пролапса митрального клапана: болей в грудной клетке, нарушений ритма сердца, бактериального эндокардита, эмболий и разрыва хорд. В предельных случаях часто невозможно отличить пролапс от молотящей створки и массивных вегетаций на митральном клапане (рис. 8.10).
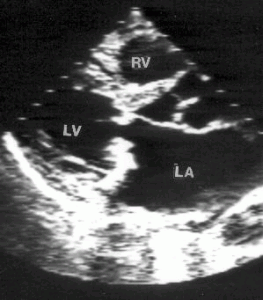
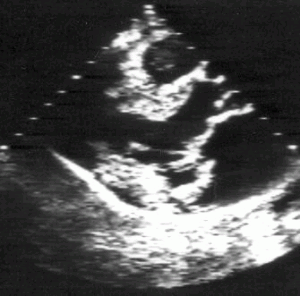
Рисунок 8.10. Миксоматозная дегенерация митрального клапана, осложнившаяся разрывом хорд и молотящей задней створкой митрального клапана. Парастернальная позиция длинной оси левого желудочка, диастола (А) и систола (В). RV — правый желудочек, LV — левый желудочек, LA — левое предсердие.
Бактериальный эндокардит стали существенно лучше диагностировать с появлением эхокардиографии; расширился диапазон сведений об этой болезни. Прямым и главным признаком бактериального эндокардита при поражении любого клапана служит обнаружение вегетаций. Нарушая целостность створок или хорд, вегетации препятствуют полному закрытию клапана и приводят к митральной недостаточности. Вегетации выглядят как образования на клапанах, обычно весьма подвижные. Обнаружение образований на клапанах при наличии клинических подозрений на бактериальный эндокардит почти всегда позволяет верно поставить диагноз. За свежие вегетации можно, однако, принять и миксоматозную дегенерацию митрального клапана, и старые, «зажившие», вегетации, и разорванную створку или хорду. С другой стороны, если эхокардиографическое исследование проводят вскоре после появления первых клинических симптомов бактериального эндокардита, вегетации можно и не обнаружить. Вегетации небольших размеров могут остаться невыявленными при эхокардиографическом исследовании из-за недостаточной разрешающей способности аппарата, низкого отношения сигнала к шуму либо из-за недостаточной квалификацией или невнимания эхокардиографиста. В Лаборатории эхокардиографии UCSF распознать вегетации диаметром менее 5 мм при М-модальном исследовании почти никогда не удавалось. Двумерное исследование в таких случаях обычно выявляло некоторые изменения створок, но не вегетации. В то же время М-модальное исследование больных с подозрением на бактериальный эндокардит имеет то преимущество перед двумерным исследованием, что позволяет обнаружить нарушение целостности клапана, поскольку регистрирует высокочастотные систолические вибрации, невидимые при двумерном исследовании из-за меньшей временной разрешающей способности.
Нужно иметь в виду, что бактериальный эндокардит обычно поражает исходно измененные клапаны; поэтому распознать вегетации малых размеров (менее 5 мм) на фоне имеющихся изменений клапана почти невозможно. Хорошим примером возможных диагностических трудностей может служить миксоматозная дегенерация митрального клапана с разрывом хорд (рис. 8.10). В этом случае обнаруживается большое, подвижное, пролабирующее, некальцинированное образование, дающее систолическую вибрацию. Диагностику при подобных эхокардиографических находках следует основывать на клинической картине и бактериологических исследованиях крови.
Самый надежный метод выявления вегетаций — чреспищеводная эхокардиография (рис. 16.16). Ее чувствительность при клинически подтвержденном бактериальном эндокардите превышает 90%. Мы рекомендуем проведение чреспищеводной эхокардиографии во всех случаях, когда вегетации не выявлены при трансторакальном исследовании, но имеются подозрения на наличие у пациента бактериального эндокардита.
